| a | a | a |
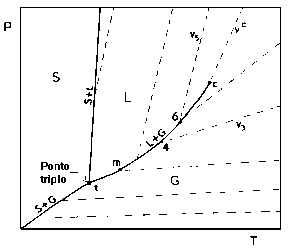
Pressão de Vapor e Entalpia de Vaporização de Substâncias Puras A linha t-c da Figura 1 (Projeção PT da Superfície PVT) é a curva de pressão de vapor em função da temperatura.
Figura 1: Superfície PVT para substância pura: Projeção PT (Para ver a figura ampliada, clique aqui).. A curva da Pressão de Vapor é descrita pela equação de Clapeyron:
onde:
A equação de Clapeyron vem sendo simplificada por vários autores, como, por exemplo, a equação de Antoine:
onde A, B e C são constantes empíricas que podem ser obtidas no DBPRS OL (Banco de Dados de Propriedades das Substâncias On-Line), no endereço: http://vectra.pqi.ep.usp.br/dbprs3. A equação de Capeyron permite o cálculo da entalpia de vaporização, l , a partir de dados de pressão de vapor ou pela aplicação de uma equação que calcule Pv:
Dados de l podem ser lidos no DBPRS OL (Banco de Dados de Propriedades das Substâncias On-Line), no endereço: http://vectra.pqi.ep.usp.br/dbprs3 ou calculados por equações, como a equação de Watson
sendo que 1 e 2 referem-se a estados diferentes e n é um expoente variável de substância para substância (geralmente usa-se n = 0,38). Freqüentemente considera-se, para o estado 1: T1 = Tb, e l1 = l b sendo:
valores que podem ser encontrados no DBPRS OL (Banco de Dados de Propriedades das Substâncias On-Line), no endereço: http://vectra.pqi.ep.usp.br/dbprs3. |
[topo]
|
|
|
©Copyright: Luiz Roberto Terron - 2000 - 2002 - lrterron@usp.br veja: informações sobre copyright |
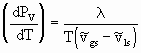 (Equação 1)
(Equação 1)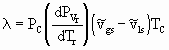 (Equação 3)
(Equação 3)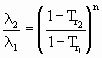 (Equação 4)
(Equação 4)