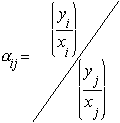| a | a | a |
A
separação de uma mistura líquida por destilação depende da diferença entre
os pontos de ebulição de seus componentes. Estudemos, então: Alguns fatos relevantes relacionados com pressão de vapor, ponto de ebulição e destilação O Diagrama de Ponto de Ebulição de Misturas
Fatos
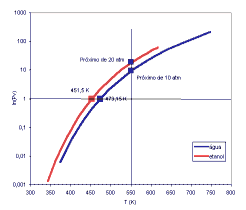
relevantes A pressão de vapor de um líquido a uma certa temperatura é a pressão de equilíbrio exercida pelas moléculas deixando e retornando à superfície do líquido. A seguir estão alguns pontos importantes relacionados com a pressão de vapor:
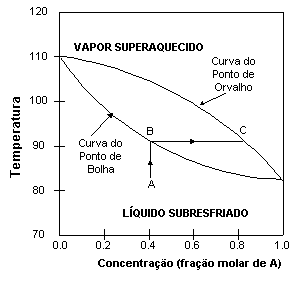
O Diagrama de Ponto de Ebulição de Misturas O Diagrama do Ponto de Ebulição de Misturas mostra como as composições de equilíbrio dos componentes em uma mistura líquida variam com a temperatura a uma pressão fixa. Considere-se, como exemplo, o caso de uma mistura líquida contendo 2 componentes (A e B) - uma mistura binária, a qual teria o diagrama mostrado na Figura 2.
O ponto de ebulição de A é aquele no qual a fração molar de A é igual a 1. O ponto de ebulição de B é aquele no qual a fração molar de A é igua a 0. Neste exemplo, A é o componente mais volátil tenso, assim, um ponto de ebulição menor do que o de B. A curva superior é chamada de curva do ponto de orvalho enquanto que a de baixo é chamada de curva do ponto de bolha. Lembrando:
A região acima da curva do ponto de orvalho mostra a composição de equilíbrio do vapor superaquecido enquanto a região abaixo da curva de ponto de bolha mostra a composição de equilíbrio do líquido subresfriado (ou comprimido). Por exemplo, quando um líquido subresfriado com fração molar = 0,4 (ponto A) é aquecido, sua concentração permanece constante até que seja atingida o ponto de bolha (ponto B), e dá-se o início a ebulição. Os vapores formados durante a ebulição têm a composição de equilíbrio dada pelo ponto C, com fração molar de A aproximadamente igual a 0,8, o que significa que é cerca de 50% mais rico em A do que o líquido original.
A volatilidade relativa é a medida da diferença de volatilidade entre dois componentes e, então, entre seus pontos de ebulição. Ela indica o grau de dificuldade (ou de facilidade) para a realização de uma determinada separação. A volatilidade relativa do componente i com relação ao componente j é definido como:
onde:
Quando a volatilidade relativa entre dois componente é muito próxima de 1, esta é uma indicação de que os característicos da pressão de vapor de ambos são muito próximas, significando que os pontos de ebulição apresentam valores semelhantes e a separação dos dois componentes, por destilação, será difícil |
[topo]
|
|
|
©Copyright: Luiz Roberto Terron - 2000 - 2002 - lrterron@usp.br veja: informações sobre copyright |