| a | a | a | Vamos ver, primeiramente, o que é a Constante de Equilíbrio Líquido-Vapor, K. A seguir, serão estudadas as Curvas de Equilíbrio Líquido-Vapor. As curvas de Equilíbrio Líquido-Vapor são usadas no projeto de Colunas de Destilação.
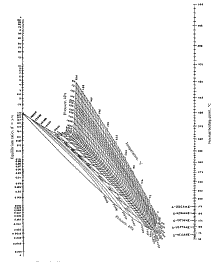
Constante de Equilíbrio Líquido-Vapor, K Na condição de equilíbrio líquido-vapor de misturas, pode-se definir uma constante de equilíbrio líquido-vapor, Ki, pela equação: . onde yi = fração molar do componente i na fase vapor xi = fração molar do componente i na fase líquida. Essa grandeza pode ser determinada através de dados experimentais de equilíbrio líquido-vapor (ELV) ou estimada usando-se relações termodinâmicas, fugacidade, atividade, equações de estado, etc.. Existem ábacos que possibilitam leituras de K para alguns sistemas, como mostrado na Figura 1.
Dados experimentais de ELV são apresentados em forma gráfica, constituindo as Curvas ELV, discutidas a seguir. essas curvas são usadas no projeto de colunas de destilação. Para soluções líquidas ideais, líquidos sendo considerados incompressíveis e baixas pressões, a constante K pode ser calculada com:
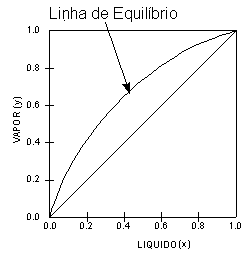
onde Pv é a pressão de vapor e P a pressão do sistema. Esse método, devido às simplificações impostas, é bastante limitado. Ver também Lei de Raoult. Curvas de Equilíbrio Líquido-Vapor, Curvas ELV Dados ELV a pressão constante são obtidos a partir de diagramas de ponto de ebulição. Tais dados para misturas binárias são apresentadas como um gráficos mostrado na Figura 1. Esse gráfico expressa o ponto de bolha e o ponto de orvalho de misturas binárias a pressão constante. A linha curva é chamada de linha de equilíbrio e descreve as composições do líquido e do vapor, em equilíbrio, a uma certa pressão.
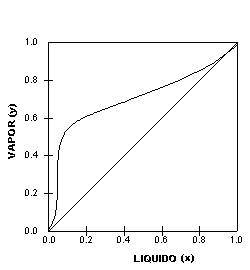
O gráfico da Figura 2 mostra dados de ELV de uma mistura binária que, apresentando característicos uniformes de equilíbrio líquido-vapor, é relativamente fácil de separar. Os gráficos apresentados na Figura 3, por outro lado, mostram sistemas não ideais que são mais difíceis de separar.
Figura 2: Curvas de Equilíbrio Líquido-Vapor (ELV) de misturas binárias, a uma pressão fixa - Sistemas não ideais. Algumas misturas formam azeótropos. a
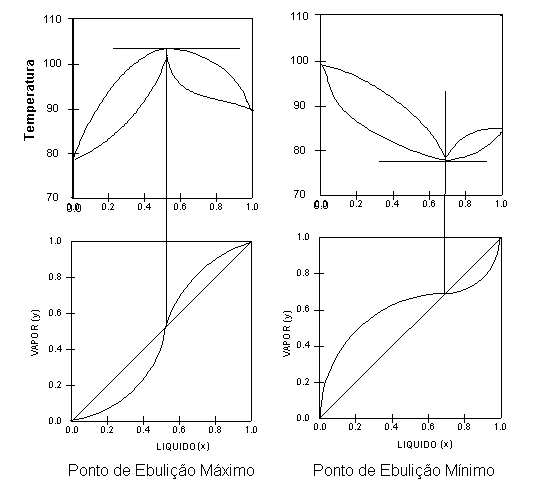
Os gráficos da Figura 3 mostram dois sistemas azeotrópicos, um com um ponto de ebulição máximo e outro com ponto de ebulição mínimo. Em ambos os gráficos, a curva de equilíbrio cruza a linha diagonal e o ponto assim formado chama-se ponto de azeotropia: é o ponto onde ocorre o azeótropo:
Note as formas das respectivas linhas de equilíbrio em relação á linha diagonal que divide o gráfico ELV em duas partes. Ambos os gráficos apresentados na Figura 3 caracterizam sistemas azeotrópicos homogêneos. Um azeótropo homogêneo não pode ser separado por destilação convencional. Usam-se procedimentos especiais para isso:
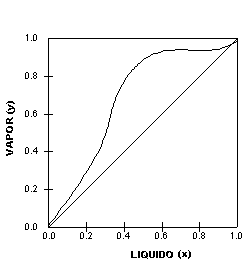
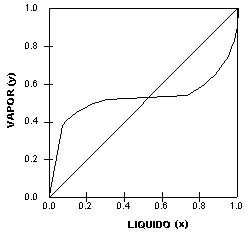
Na Figura 4 vê-se um outro tipo de sistema onde a linha de equilíbrio apresenta uma porção "achatada". Nesse caso, diz-se que existe um azeótropo heterogêneo.
Um azeótropo heterogêneo pode ser separado em duas fases, ou seja, por duas colunas de destilação pois tais sistemas, geralmente, formam duas fases líquidas cujas composições são muito diferentes. Mais Informações sobre Equilíbrio de Fases no site: |
[topo]
|
|
|
©Copyright: Luiz Roberto Terron - 2000 - 2002 - lrterron@usp.br veja: informações sobre copyright |