
VARIÁVEIS DO PROCESSO ELETROQUÍMICO
Para as eletrodeposições, foi utilizado o esquema tradicional de três eletrodos. Utilizamos como eletrodo de trabalho um disco de cobre, como contraeletrodo uma placa de platina e como eletrodo de referência um eletrodo de prata/cloreto de prata, o qual apresenta potencial padrão de redução de -0,225V na escala de hidrogênio. Para a aplicação e controle dos potenciais, utilizamos um potenciostato Autolab controlado por computador. A Figura 2 mostra o arranjo experimental, e a Figura 3 mostra um detalhe do porta-amostras utilizado para discos de cobre, que expõe uma área de 1cm2. Nas deposições sobre substratos que não se adaptam às dimensões do porta-amostras, eles eram sustentados por meio de garras acima da solução. A área exposta, neste caso, era medida após a deposição. As eletrodeposições foram realizadas com e sem agitação. Para as deposições com agitação utilizou-se um agitador magnético.

Figura 2
– Potenciostato/galvanostato, célula e assessóriosUtilizamos soluções contendo apenas cátions de cobre ou de cobalto. A faixa de potenciais foi de –1,8 a 0,2V, e a taxa de varredura foi de 0,005V/s para o cobalto e 0,001V/s para o cobre. As curvas obtidas para eletrólitos com 1,000mol/l de cobalto e 0,010mol/l de cobre são apresentadas na Figura 4.
Observamos que o potencial adequado para a eletrodeposição de cobre fica entre –0,460 e –0,480V. Para as novas deposições a serem feitas, adotamos desta vez o potencial de –0,475V, pois neste valor a corrente para o cobalto é nula, porém mais próxima das correntes negativas (devemos evitar correntes positivas, que corresponderiam a corrosão do cobalto previamente depositado) e para o cobre é suficientemente negativa para que se obtenha a camada em tempos razoáveis. Por outro lado, o potencial de deposição para o cobalto deve ser mais negativo, porém superior a –1,7V, pois, abaixo deste valor, o módulo da densidade de corrente do cobre cresce muito rapidamente. Dados da literatura, entretanto, sugerem que devemos nos limitar a valores em torno de –1,0V, pois potenciais mais negativos que este levam a depósitos irregulares e a codesprendimento de hidrogênio. Adotamos, assim, este valor, ao invés do valor de –1,1V adotado nos primeiros experimentos.
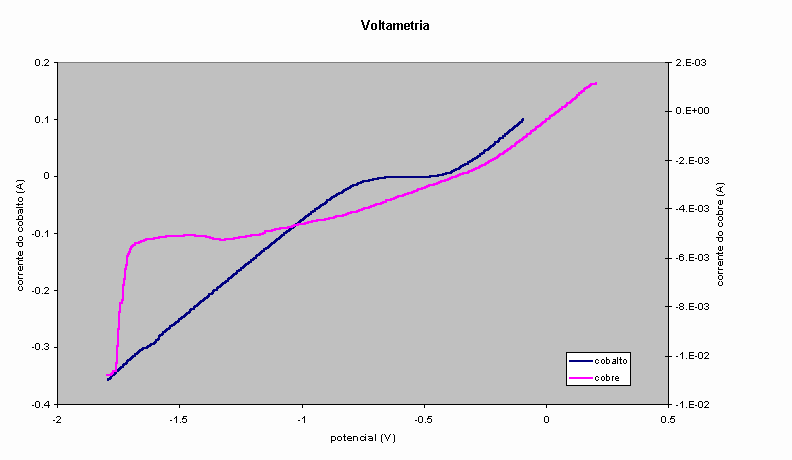
Figura 4 – Curvas voltamétricas
Definidos os potenciais de –0,475V e –1,000V, foram realizadas novas deposições de monocamadas espessas de cobre e de cobalto, para observação do processo, determinação da eficiência de corrente e observação do depósito.
Oxidação do depósito de cobalto
Observamos que alguns depósitos de cobalto estavam recobertos por uma fina camada escura após a deposição. Acreditamos tratar-se de oxidação do depósito, promovida pelo oxigênio gasoso gerado no contra-eletrodo:
2H2O ® O2 + 4H+ + 4e- (I)
Esta reação deve provocar acidificação da solução. Efetivamente, verificou-se um abaixamento do pH de 5,4 para 2,4 ao longo da deposição. Além disso, observou-se o desprendimento do gás. O oxigênio gasoso, que permanece na solução, possivelmente é o responsável pela oxidação superficial do depósito de cobalto, ao final da deposição:
2Co + O2 ® 2CoO (II)
Durante a deposição, o potencial negativo favorece a formação do cobalto metálico. Assim, ela deve ocorrer com circuito aberto, após o final da eletrodeposição. Deste modo, passou-se a evitar a oxidação retirando-se o depósito da solução no mesmo momento da interrupção do processo eletroquímico. Alternativamente, poderíamos ter utilizado uma membana porosa separando os compartimentos catódico e anódico, mas isto não se mostrou necessário nesta etapa.
Observamos também que o contraeletrodo de platina ficava revestido por uma camada preta quando se aplicava o potencial catódico mais negativo, correspondente à camada catódica de cobalto. Esta camada preta, portanto, era resultante de um processo anódico, provavelmente a oxidação dos cátions Co2+ a Co3+ ou Co4+. Se ocorrer a formação de Co3+, forma-se o óxido Co3O4, que contém cátions Co2+ e Co3+:
3Co2+ + 4H2O ® Co3O4 + 8H+ + 2e- (III)
Pode-se também formar o Co4+:
Co2+ + 2H2O ® CoO2 + 4H+ + 2e- (IV)
Curvas típicas de corrente em função do tempo durante a eletrodeposição de cobalto são apresentadas nas Figuras 5 e 6. Observa-se que a densidade de corrente no início da deposição era de cerca de 0,03A/cm2, e após a estabilização era de cerca de 0,02A/cm2.
Nos primeiros 50s, a corrente aumenta ligeiramente em módulo, mantendo-se em seguida constante por cerca de 150s, decaindo depois rapidamente para um patamar em módulo mais baixo. Esta mudança brusca possivelmente pode ser explicada pelo recobrimento total da camada de cobre, passando a deposição a ocorrer sobre o próprio cobalto. A deposição sobre o cobre seria cineticamente mais favorável que a deposição sobre cobalto.
Tal como nas deposições de cobalto descritas no Primeiro Relatório, observou-se a formação de nódulos sobre os depósitos. A Figura 7 apresenta uma micrografia óptica da superfície do depósito, onde se observa um nódulo.
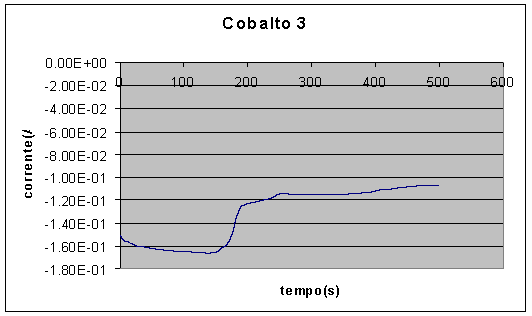
Figura 5 – Deposição de camada de cobalto, sem agitação (área » 5cm2)
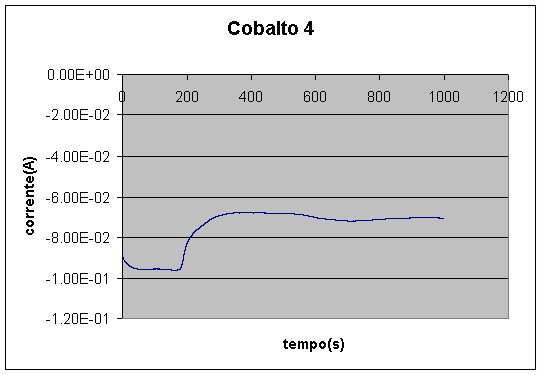
Figura 6 – Deposição de camada de cobalto, sem agitação (área » 3cm2)

Figura 7 – Micrografia óptica da superfície do depósito de cobalto (aumento aproximado de 300x)
Uma curva típica de corrente em função do tempo durante a eletrodeposição do cobre é mostrada na Figura 8. A densidade de corrente no início da deposição era de cerca de 0,001A/cm2, e após a estabilização era de cerca de 0,0005A/cm2. Observa-se uma diminuição inicial forte do módulo da corrente, e uma gradativa diminuição desta variação, até se chegar a um comportamento aproximadamente constante. A diminuição inicial pode ser explicada pela grande diminuição da concentração de cátions de cobre na solução vizinha ao catodo.
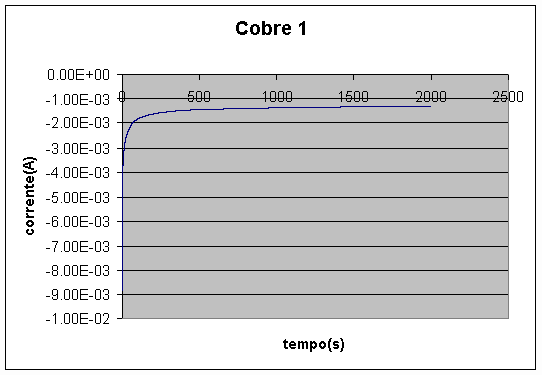
Figura 8 – Deposição de camada de cobre, sem agitação (área » 3cm2)
Efeito da agitação
O efeito de diminuição do módulo da corrente de deposição de cobre foi amortecido pela introdução de agitação na solução, como mostra a Figura 9. A agitação tem o efeito de redistribuir os cátions na solução, diminuindo a espessura da camada de difusão. Como já mencionado, os baixos valores de corrente obtidos para o cobre são desejáveis para que a codeposição de cobre durante a obtenção da camada de cobalto não seja excessiva, permitindo que se obtenha uma camada de cobalto com pequeno teor de cobre. Esta diminuição da corrente, em relação à que seria obtida se utilizássemos concentrações maiores de cátions de cobre na solução, em parte decorre do deslocamento do potencial de equilíbrio da deposição do cobre ( Cu2+ + 2e- Û Cu) para valores mais negativos, de 0,115 para 0,056V, conforme a equação de Nernst.
A maior parte da diminuição da corrente, contudo, deve ser atribuída a fatores cinéticos, seja na etapa eletroquímica, seja na etapa de transporte. Na etapa de transporte, como já comentamos, realmente verificamos um efeito muito forte no caso do cobre, como evidenciado pela Figura 9. No caso do cobalto, cuja concentração na solução é elevada, a etapa de transporte não tem um peso tão grande, como mostra a Figura 10, que deve ser comparada com as Figuras 5 e 6.
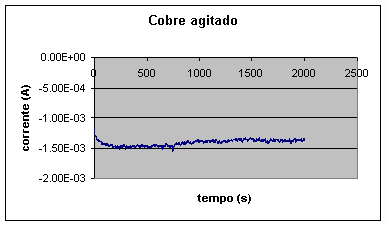
Figura 9 – Deposição de camada de cobre, com agitação (área: 1cm2)
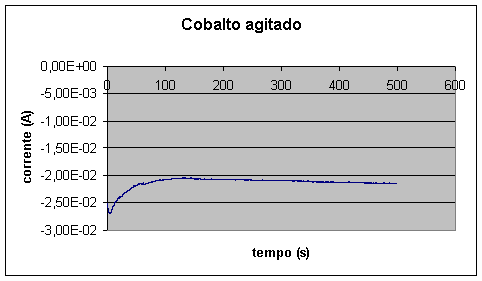
Figura 10 – Deposição de camada de cobalto, com agitação (área: 1cm2)
Nas deposições efetuadas com agitação, a densidade de corrente inicial para o cobalto é aproximadamente 0,027A/cm2 e a final é 0,021A/cm2, enquanto que para o cobre a inicial é 0,0013A/cm2 e a final é 0,0014A/cm2. Observamos que a agitação aumenta a densidade de corrente do cobre. No caso do cobalto, não há mudança notável em termos de densidade de corrente, pois a solução de cobalto é muito mais concentrada que a de cobre, ou seja, a camada de difusão para o cobalto é bem mais fina, existindo assim uma boa distribuição dos íons de cobalto na solução durante a eletrodeposição, o que não ocorre para o cobre. Em nosso caso, o aumento da densidade de corrente do cobre é indesejável, pois implica em maior contaminação da camada de cobalto.
Eficiência de corrente
As eficiências de corrente obtidas nos novos potenciais foram também elevadas.. A Tabela II apresenta alguns valores típicos.
Tabela II – Eficiência de corrente para deposições típicas de cobre e de cobalto
|
cobre |
cobalto |
|
|
corrente média (A) |
-0,0024 |
-0,1315 |
|
tempo (s) |
2000 |
500 |
|
carga acumulada (C) |
-4,774 |
-65,747 |
|
massa esperada (g) |
0,0016 |
0,0204 |
|
massa depositada (g) |
0,0016 |
0,0200 |
|
eficiência de corrente (%) |
100 |
98 |
Estes valores mostram que o desprendimento de hidrogênio ocorreu em pequena quantidade. A reação de desprendimento de hidrogênio é dada por:
H+ + e- ® 1/2 H2 (V)
Na escala do eletrodo de Ag/AgCl, utilizada em nossos experimentos, o potencial de equilíbrio desta reação para pH=5 (valor observado no início da deposição), pela equação de Nernst, vale -0,52 V.
Este valor é superior ao potencial utilizado para o cobalto, –1,0V, e portanto, do ponto de vista termodinâmico, a reação deve ocorrer. Sua pequena intensidade, portanto, deve ser atribuída a fatores cinéticos. Efetivamente, a literatura mostra que a sobretensão de ativação desta reação sobre cobre e sobre cobalto é elevada. As constantes a e b de Tafel são 0,87 e 0,12 , respectivamente, para o cobre, e 0,62 e 0,14 para o cobalto.
Como já mencionado, o objetivo final do projeto é obter multicamadas com camadas individuais de espessura de 0,5 a 10nm. Entretanto, para verificarmos a eficácia do método de deposição adotado, decidimos inicialmente produzir multicamadas com camadas mais espessas, da ordem de 1 a 5m m. Estes resultados são apresentados nos textos "Método do Eletrólito Único" e "Caracterização Microestrutural de Multicamadas Espessas".
Estes resultados são apresentados no texto "Multicamadas Finas – Estudo da Corrosão do Cobalto no Início da Etapa de Deposição do Cobre".
A discussão das variáveis eleroquímicas na obtenção dos nanofios é descrita no texto "Nanofios – Experimentos Iniciais".