| a | a | a |
Mudança de fase:
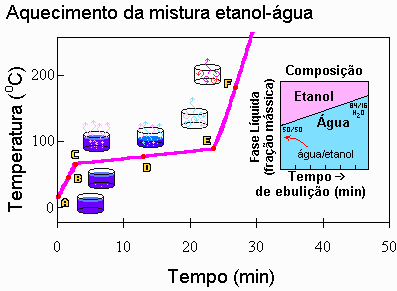
Líquido-Vapor Vimos então como se comportam as substâncias puras quando mudam de fase. Vamos ver agora o que acontece com as misturas. Note que serão apresentados conceitos importantes para o nosso estudo: Vaporização de Misturas Vamos repetir a experiência feita para uma substância pura só que, agora em vez de ter-se água pura no recipiente colocado dentro do forno, tem-se uma mistura de água e álcool etílico com a concentração, em fração mássica de 0,5 (ou seja, 50 g de água e 50g de álcool, por exemplo). O álcool etílico, a pressão ambiente (1 atm) ferve a 78,3 oC e a água, como dissemos, a 100 oC. O que irá acontecer nessa nova situação? A temperatura irá ficar constante enquanto a mistura ferve? Com essas questões na mente, iniciamos o experimento e observamos o que acontece com as leituras de temperatura fornecidas pelo termômetro. Os fatos estão relatados a seguir
Ponto A: A mistura etanol-água foi colocada no forno. O líquido ainda está frio. Ponto B: A mistura começa a se aquecer e a temperatura aumenta com uma velocidade maior do que a observada no experimento anterior (com água pura). Isso era esperado pois a capacidade calorífica do etanol é 2.8 kJ/kg C e a da água é 4.2 kJ/kg oC e a da mistura estará entre esses dois valores. Ponto C: Aparece a primeira bolha no fundo do recipiente que contém o líquido. ela sobe à superfície. Se coletássemos essa bolha, uma análise mostraria que seria rica em etanol. Enquanto o líquido é formado por 50% de etanol e 50% de água, essa primeira bolha de vapor conteria 65% de etanol. Isso acontece pois o etanol tendo ponto (ou temperatura) de ebulição menor do que o da água apresenta uma tendência para entrar em ebulição em primeiro lugar. Essa temperatura (80 oC) é chamada de Ponto de Bolha, ou Temperatura do Ponto de Bolha ou, ainda, Temperatura de Bolha, pois assinala a formação da primeira bolha. Ponto D: O etanol e a água continuam a ferver. Entretanto a temperatura não permanece constante como no caso da água pura: ela sobe lentamente. O calor latente de vaporização (ou entalpia de vaporização) continua a existir: é o causador da lenta ascensão da temperatura, mas a sua presença não é tão óbvia como no caso das substâncias puras (como no caso anteriormente estudado da água pura). A temperatura sobe pois a fase líquida está sendo, cada vez mais. enriquecida com água, a qual tem ponto de ebulição maior. Ponto E: A última gota de líquido que evapora é muito rica em água (84% de água). A temperatura em que isso acontece é chamada de Ponto de Orvalho, ou Temperatura do Ponto de Orvalho ou, ainda Temperatura de Orvalho (85 Ponto F: A temperatura do vapor dentro do recipiente (mais a que já está espalhada no ambiente, mais as diversas partes do forno) irá aumentar até que o equilíbrio térmico seja atinjido: tudo estará na mesma temperatura. Sumário dos acontecimentos:
|
[topo]
|
|
|
©Copyright: Luiz Roberto Terron - 2000 - 2002 - lrterron@usp.br veja: informações sobre copyright |