| a |
a |
a |
Primeiramente, vamos ver como se comportam as
substâncias puras quando mudam de fase, passando de líquido para vapor, ou
seja como vaporizam. Depois o mesmo será feito para misturas...
Vaporização de um
componente puro
Imagine um recipiente cheio de água pura
(contendo 1 kg de água) que é colocado em um forno bem aquecido (mais do que
300 oC e vamos supor que ele consuma uma potência de 5kW). A
pressão dentro do forno é a atmosférica (Pressão = 1 atm). A água será
aquecida e, depois de certo tempo, ela irá ferver. Enquanto ela ainda estava
fria, colocamos um termômetro na água de tal modo que fosse possível
observarmos a variação da temperatura (T) durante o processo de aquecimento.
Com os dados de
T = f(Tempo)
constrói-se o gráfico da Figura 1.
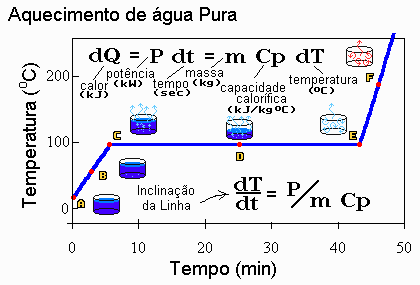
Figura 1: Variação da temperatura com o tempo no
aquecimento de água pura (Pressão = 1 atm).
- Ponto A: O recipiente com água
acabou de ser colocada no forno. O líquido está na temperatura
ambiente (mais ou menos 20 oC), mas, com a adição de
calor, ela não ficará nessa temperatura por muito tempo. Como a
temperatura está abaixo da temperatura de ebulição na pressão
atmosférica (que é 100 oC), diz-se que a água está sub-resfriada
ou comprimida.
- Ponto B: A água é aquecida
lentamente. Enquanto o calor é transferido para a água (capacidade
calorífica, Cp = 4.2 kJ/kg oC), nota-se um aumento de
temperatura, lido no termômetro.
- Ponto C: A primeira bolha de
vapor d'água aparece no fundo do recipiente e sobe para a superfície
do líquido. A bolha ascende pois sua densidade é menor do que a do
líquido e a gravidade assegura que fluidos mais densos deslocam os
menos densos.
- Ponto D: A água líquida entra
em franca ebulição, convertendo-se em vapor. Mas o termômetro não
acusa variação de temperatura (ela ficou fixa em 100 oC).
O aquecimento não foi interrompido e a temperatura do forno ainda é
maior do que a da água, desse modo, sabe-se que o calor ainda está
sendo transferido para a água. parece, então que, quando um composto
passa da fase líquida para a vapor, certa quantidade adicional de
calor é absorvida. esse calor não causa um aumento de temperatura e
sim a mudança de fase (no caso, de água líquida para vapor
d'água). Esse fato foi observado por Joseph Black, em 1765, o qual
chamou esse comportamento de "calor escondido". Hoje ele é
chamado de Calor Latente de
Vaporização ou Entalpia de Vaporização, mas a idéia é a
mesma. Algum calor é necessário para tornar a água em vapor (2257
kJ/kg). Observando-se o processo global de vaporização, na realidade
essa é uma grande quantidade, comparada com a quantidade consumida
nas outras etapas do processo (o aquecimento da água até a
formação da primeira bolha e o posterior aquecimento do vapor que
preencherá o ambiente do forno). De modo semelhante, o vapor entrega
a mesma quantidade de calor quando é condensado.
- Ponto E: A última gota de
líquido vaporiza e, no recipiente e no ambiente do forno restará
somente vapor d'água e ar. A temperatura, marcada pelo termômetro
irá subir novamente e o vapor passará ao estado de
"super-aquecido". A temperatura irá subir mais rapidamente
do que quando estávamos aquecendo a água pois o vapor tem capacidade
calorífica menor do que a da água líquida.
- Ponto F: A temperatura do vapor e
dos outros componentes da nossa pesquisa (recipiente que continha a
água, paredes do forno, etc...) irá aumentar até que todos os
elementos envolvidos estejam na mesma temperatura do forno. Nenhum
calor será transferido e o termômetro marcará uma temperatura
constante.
Sumário dos acontecimentos:
- Componentes puros têm a capacidade de
absorver calor, e, nesse processo, aquecer-se;
- Componentes puros entram em ebulição
quando atingem uma temperatura chamada de temperatura ou ponto de
ebulição. Lembrar que a temperatura de ebulição, quando a
pressão é atmosférica, é chamada de temperatura ou ponto de
ebulição normal;
- Quando é atingida a temperatura de
ebulição, ela permanece constante, mesmo quando o calor é ainda
adicionado ao líquido. Essa temperatura fica constante até que
todo o líquido seja vaporizado;
- Durante a ebulição, o calor é transferido
para a água, mas a sua temperatura não se alteraWhile e nem a do vapor
formado. Esse "calor escondido" é chamado de Calor Latente de
Vaporização ou Entalpia de Vaporização;
- Quando todo o líquido vaporizou, a
temperatura do vapor irá aumentar até que o vapor e todos os elementos
envolvidos na experiência estejam na mesma temperatura
Extensão da Pesquisa:
Imagine, agora, que fossem feitas várias
experiências, variando a pressão dentro do forno. Umas maiores do que a
pressão atmosférica, outras menores. Em cada caso seria coletada a
temperatura de ebulição. Notar-se-ia que, quanto maior a pressão, maior
seria a temperatura de ebulição. Se os pontos experimentais fossem
colocados em um gráfico de Temperatura em função da pressão, a curva
originada seria a curva da pressão de vapor (veja a página sobre Pressão
de Vapor e sobre Gases, Líquidos e
Sólidos).
|
