| a | a | a |
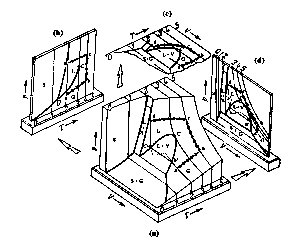
Gases, Líquidos, Sólidos e...Vapores A superfície PVT de substâncias puras As condições de temperatura, pressão, volume e quantidade de matéria determinam o estado de agregação de uma substância: se estará no estado sólido, líquido ou gasoso. Como, geralmente, usa-se, como variável "volume", o volume específico (o volume dividido pela quantidade de matéria), o conjunto de grandezas citado é chamado de Propriedades PVT (pressão, volume e Temperatura). As propriedades PVT originam um diagrama tridimensional, mostrado na Figura 1, que tem como eixos a pressão, o volume molar (se a quantidade de matéria for o mol) e a temperatura: a superfície PVT.
Figura 1: Superfície PVT típica para uma substância pura: a superfície completa e suas projeções PT, TV e PV ( Para ver a figura ampliada, clique aqui).Normalmente consideram-se as projeções PT, TV e PV. Na Figura 2 está esquematizada a projeção PV e Figura 3 a projeção PT.
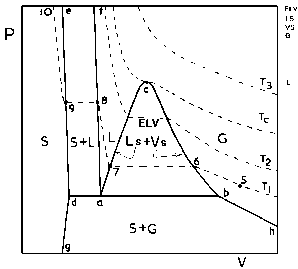
Figura 2: Superfície PVT para substância pura: Projeção PV ( Para ver a figura ampliada, clique aqui).Nessas figuras, tem-se:
Quer saber mais sobre essas definições? Vá para a página que trata de vaporização de líquidos puros. As regiões marcadas com as letras S, L e G representam, respectivamente, as fases sólida, líquida e gasosa (gás supercrítico e subcrítico). As regiões onde se tem L+V, S+G e S+L, representam os estados heterogêneos onde coexistem, respectivamente, líquido e vapor saturados, sólido e vapor saturado e sólido e líquido saturado. Nessas regiões, as duas fases lá existentes, estão em equilíbrio. O ponto C corresponde ao ponto crítico. Na Figura 1, vê-se 6 isotermas (isotermas 0 a 5).
Percorrendo algumas dessas isotermas, da esquerda para a direita, ou seja, quando diminui-se a pressão e
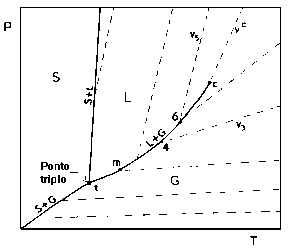
A projeção (ou diagrama) PT Quando a superfície PVT é projetada no plano PT (veja a Figura 3), tem-se que:
Figura 3: Superfície PVT para substância pura: Projeção PT ( Para ver a figura ampliada, clique aqui)..A curva da pressão de vapor vem sendo modelada por vários autores; alguns desses modelos serão vistos adiante (equações para a estimativa da pressão de vapor em função da temperatura). Como a projeção PT, ao contrário da projeção PV, mostra de modo distinto os limites entre as diversas fases, ela é, freqüentemente, chamada de diagrama de fases. Propriedades do Equilíbrio Líquido-Vapor (ELV) de substâncias puras de interesse para a Destilação Para o estudo da destilação (assim como para várias Operações Unitárias), certas propriedades do Equilíbrio Líquido-Vapor (ELV) de substâncias puras devem ser conhecidas para cálculos e dimensionamento de equipamentos. São elas:
Essas propriedades podem ser coletadas no DBPRS OL (Banco de Dados de Propriedades das Substâncias On-Line), no endereço: http://vectra.pqi.ep.usp.br/dbprs3 Veja, também, a página sobre Pressão de Vapor e Entalpia de Vaporização e aprenda mais sobre os estados líquido, gasoso, vapor e mudança de fase nas páginas sobre Vaporização de Substâncias Puras e Misturas. |
[topo]
|
|
|
©Copyright: Luiz Roberto Terron - 2000 - 2002 - lrterron@usp.br veja: informações sobre copyright |